2025年2月13日,南京中醫(yī)藥大學(xué)醫(yī)學(xué)院,鼓樓臨床醫(yī)學(xué)院林煒教授團隊、鼓樓臨床醫(yī)學(xué)院感染科李婕教授團隊、浙江大學(xué)醫(yī)學(xué)院馮鈺教授團隊合作在Nature子刊Nature Communications雜志上發(fā)表了題為Structural insights into transcription regulation of the global OmpR/PhoB family regulator PhoP from Mycobacterium tuberculosis的研究成果。該研究解析了結(jié)核分枝桿菌毒力因子PhoP與靶標(biāo)基因啟動子DNA及RNA聚合酶的復(fù)合物電鏡結(jié)構(gòu),揭示了PhoP靈活調(diào)控磷源、氮源壓力應(yīng)激基因轉(zhuǎn)錄的雙重轉(zhuǎn)錄調(diào)控機制,為全面認(rèn)識結(jié)核分枝桿菌在宿主體內(nèi)的逆境生存調(diào)控機制奠定了基礎(chǔ),該研究是林煒教授團隊繼Mol. Cell(2017, 2018)、Nat Commun(2019)、Nucleic Acids Res(2020, 2021, 2022a, 2022b)、PNAS(2023)、iScience(2024)之后在病原微生物基因轉(zhuǎn)錄調(diào)控機制研究和新型抗感染藥物靶標(biāo)發(fā)現(xiàn)領(lǐng)域取得的又一項系統(tǒng)性創(chuàng)新成果。

結(jié)核病,是由結(jié)核分枝桿菌感染導(dǎo)致的一類慢性傳染性疾病。據(jù)世界衛(wèi)生組織(WHO)數(shù)據(jù)顯示,2024年全球結(jié)核病發(fā)病人數(shù)約為1080萬,死亡人數(shù)約為125萬。目前,對于活動性結(jié)核病患者的治療主要采用以利福平、異煙肼、鏈霉素等為抗感染藥物的長期聯(lián)合治療方案。經(jīng)過治療后,大部分侵入人體的細(xì)菌被清除,但是仍有小部分耐藥菌以休眠的形式潛伏在宿主體內(nèi),造成持續(xù)性感染。全球大約25%的人屬于結(jié)核病潛伏感染者,破解結(jié)核潛伏感染問題已成為開發(fā)新型抗結(jié)核感染藥物的主要難點。
轉(zhuǎn)錄是病原微生物的核心生命活動,由高度保守的RNA聚合酶執(zhí)行,多樣化的轉(zhuǎn)錄因子調(diào)控轉(zhuǎn)錄起始是病原微生物高效調(diào)控應(yīng)激基因表達快速響應(yīng)環(huán)境壓力變化的關(guān)鍵步驟。結(jié)核分枝桿菌是胞內(nèi)寄生菌,面對逆境條件已進化出多種信號傳導(dǎo)系統(tǒng),其中雙組分信號傳導(dǎo)系統(tǒng)的組氨酸激酶和應(yīng)答調(diào)控蛋白在細(xì)菌應(yīng)對復(fù)雜環(huán)境壓力、提高適應(yīng)性方面發(fā)揮了重要作用。在放線菌屬細(xì)菌中,PhoP不僅在磷酸鹽匱乏的情況下,參與激活磷酸鹽代謝相關(guān)基因的轉(zhuǎn)錄,同時還可與氮代謝應(yīng)答調(diào)控蛋白GlnR協(xié)調(diào)抑制氮代謝基因amtB的轉(zhuǎn)錄。作為雙功能的應(yīng)答調(diào)控蛋白,PhoP全局性調(diào)節(jié)磷、氮、碳代謝基因的轉(zhuǎn)錄,并通過調(diào)節(jié)參與毒力、脂質(zhì)合成、缺氧等100多個基因的表達而重塑結(jié)核分枝桿菌的轉(zhuǎn)錄調(diào)控網(wǎng)絡(luò),對結(jié)核分枝桿菌在宿主體內(nèi)的潛伏感染發(fā)揮著關(guān)鍵作用,但其轉(zhuǎn)錄激活與抑制的分子調(diào)控機制并不清楚。
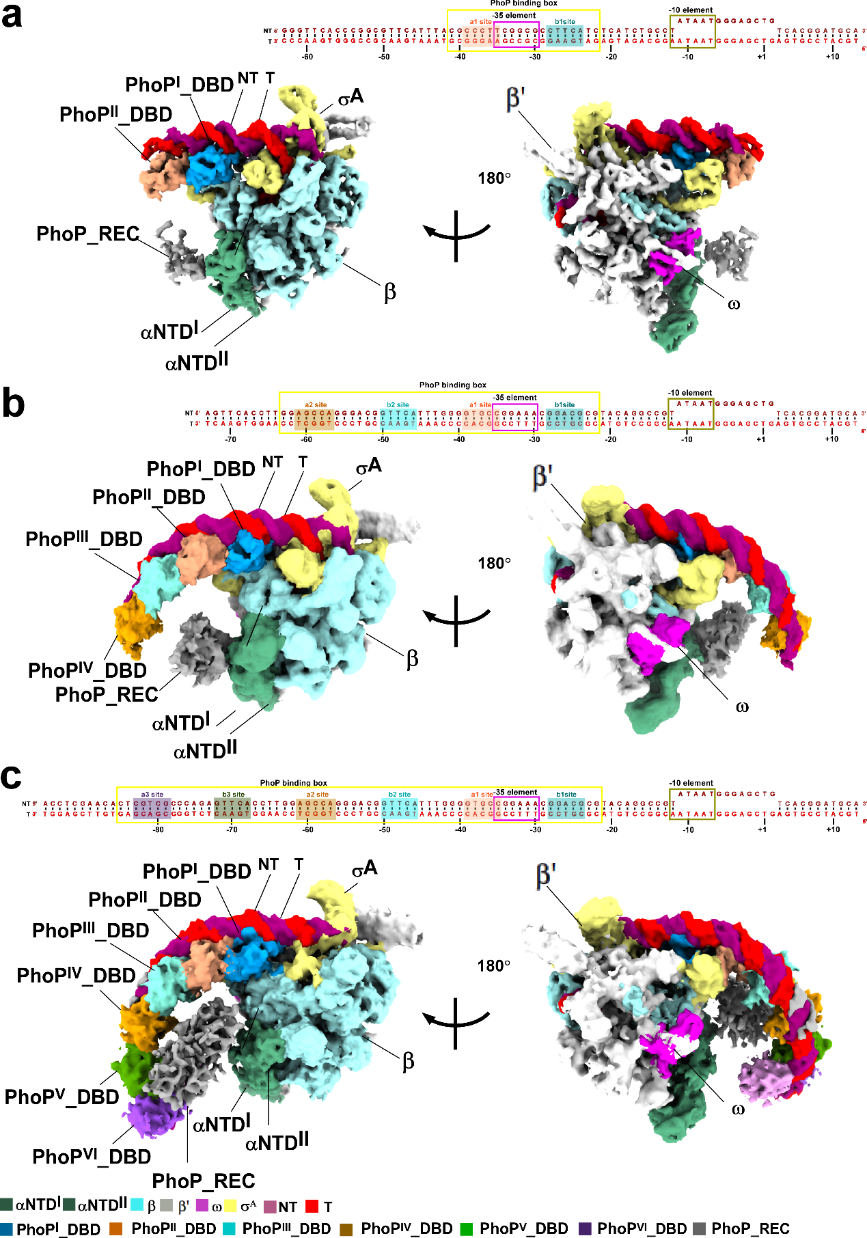
圖1 結(jié)核分枝桿菌PhoP依賴型轉(zhuǎn)錄激活復(fù)合物的冷凍電鏡結(jié)構(gòu)
本研究運用冷凍電鏡技術(shù)解析了三種結(jié)核分枝桿菌全局性調(diào)控蛋白PhoP依賴型轉(zhuǎn)錄激活復(fù)合物(PhoP-TACs)的結(jié)構(gòu),并構(gòu)建了一種PhoP依賴型轉(zhuǎn)錄抑制復(fù)合物(PhoP-TRC)的調(diào)控模型,揭示了PhoP如何與啟動子DNA、RNA聚合酶作用雙重調(diào)控下游基因轉(zhuǎn)錄的分子機制。在PhoP-TACs中,PhoP的C端DNA結(jié)合結(jié)構(gòu)域可分別首尾相連串聯(lián)成二聚體、四聚體或六聚體的方式特異識別啟動子DNA上的相應(yīng)結(jié)合位點(PHO box),PhoP的N端應(yīng)答結(jié)構(gòu)域通過與RNA聚合酶的保守結(jié)構(gòu)域廣泛相互作用而進一步穩(wěn)定復(fù)合物結(jié)構(gòu),促進轉(zhuǎn)錄起始。在PhoP-TRC中,一個PhoP二聚體通過PhoP-PHO box、PhoP-GlnR和αCTD-DNA 相互作用競爭性結(jié)合啟動子DNA上游的GlnR結(jié)合位點,并顯著扭轉(zhuǎn)DNA。PhoP 通過這種獨特結(jié)合產(chǎn)生的空間位阻效應(yīng)阻止額外GlnR分子的結(jié)合,進而發(fā)揮“競爭性抑制”轉(zhuǎn)錄的作用。該研究系統(tǒng)揭示了結(jié)核分枝桿菌PhoP依賴型雙重轉(zhuǎn)錄調(diào)控機制及共性調(diào)控元件,深化了對結(jié)核分枝桿菌磷源、氮源饑餓壓力應(yīng)激調(diào)控的認(rèn)識,可為抗結(jié)核潛伏感染藥物研發(fā)提供新靶標(biāo)和新思路。
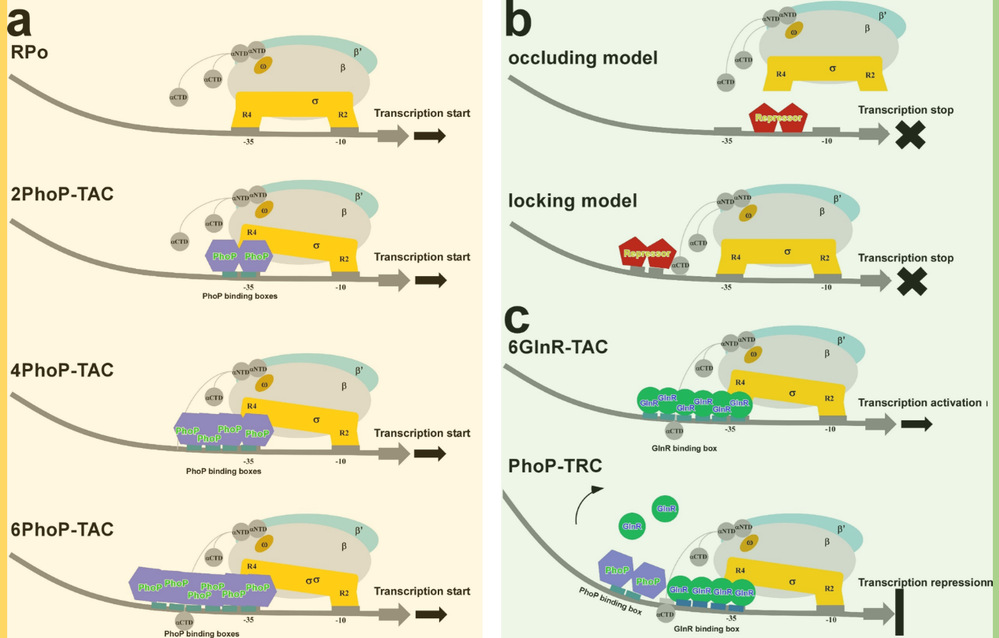
圖2 PhoP依賴型的轉(zhuǎn)錄激活與轉(zhuǎn)錄抑制調(diào)控模型
南京中醫(yī)藥大學(xué)為該論文的第一作者和通訊作者單位,南京中醫(yī)藥大學(xué)林煒教授、史婧副教授,南京中醫(yī)藥大學(xué)鼓樓臨床醫(yī)學(xué)院李婕教授,浙江大學(xué)醫(yī)學(xué)院馮鈺研究員為該論文的共同通訊作者,南京中醫(yī)藥大學(xué)史婧副教授、研究生馮貞貞、宋倩以及浙江大學(xué)醫(yī)學(xué)院博士生溫璦嘉為該論文的共同第一作者。本研究獲得了國家重點研發(fā)計劃項目(2023YFC2308200)、國家自然科學(xué)基金重大項目(81991523)、江蘇省優(yōu)秀青年基金項目(BK20230064)、江蘇高校“青藍工程”中青年學(xué)術(shù)帶頭人項目、江蘇省優(yōu)勢學(xué)科中西醫(yī)結(jié)合領(lǐng)軍團隊、江蘇省十四五重點學(xué)科基礎(chǔ)醫(yī)學(xué)、臨床醫(yī)學(xué)等項目資助。
原文鏈接如下:https://www.nature.com/articles/s41467-025-56697-x







 版權(quán)所有? 2024南京中醫(yī)藥大學(xué) 網(wǎng)站備案號:蘇ICP備15021406號-1 公安備案號:蘇公網(wǎng)安備32010602010028號
版權(quán)所有? 2024南京中醫(yī)藥大學(xué) 網(wǎng)站備案號:蘇ICP備15021406號-1 公安備案號:蘇公網(wǎng)安備32010602010028號