癌栓形成是腫瘤細(xì)胞入血后逃避免疫監(jiān)視導(dǎo)致腫瘤轉(zhuǎn)移的重要環(huán)節(jié),其中的中性粒細(xì)胞胞外DNA陷阱(neutrophil extracellular traps, NETs)作為“鋼筋”結(jié)構(gòu)參與癌栓的形成,促進(jìn)腫瘤細(xì)胞抵擋血流剪切力的機(jī)械損傷,逃避免疫細(xì)胞的殺傷,使得腫瘤細(xì)胞在轉(zhuǎn)移灶的定植存活。
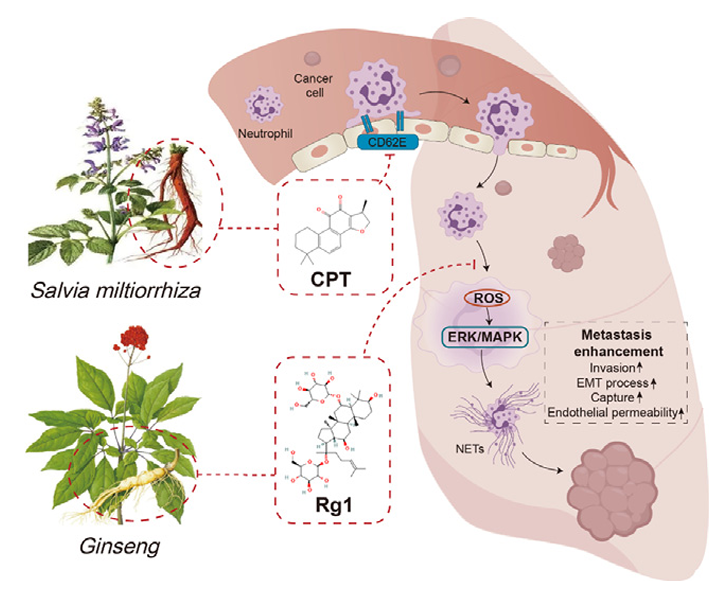
我校藥學(xué)院陸茵教授課題組長(zhǎng)期圍繞活血化瘀中藥對(duì)腫瘤轉(zhuǎn)移是促進(jìn)還是抑制這個(gè)一直困擾中醫(yī)臨床臨床的科學(xué)問(wèn)題開(kāi)展研究,前期已經(jīng)取得重要的積淀。今年,2024年10月29日在Journal of Advanced Research雜志(IF=11.4,中科院一區(qū))在線發(fā)表題為“Synergistic potentiation of the anti-metastatic effect of a Ginseng-Salvia miltiorrhiza herbal pair and its biological ingredients via the suppression of CD62E-dependent neutrophil infiltration and NET formation”的研究論文,從大量的中藥復(fù)方中發(fā)現(xiàn)來(lái)源于丹參-人參的組分配伍(隱丹參酮+人參皂苷Rg1)協(xié)同抑制腫瘤血行轉(zhuǎn)移過(guò)程中NETs介導(dǎo)的癌栓形成關(guān)鍵環(huán)節(jié),其深入的分子機(jī)制研究豐富了活血化瘀抗腫瘤血行轉(zhuǎn)移的科學(xué)內(nèi)涵,為臨床活血化瘀藥配伍抑制腫瘤轉(zhuǎn)移提供重要的支撐,為抗腫瘤轉(zhuǎn)移中藥新藥的研制提供了理論和實(shí)驗(yàn)依據(jù)。

研究發(fā)現(xiàn),人參和丹參聯(lián)合使用在抑制中性粒細(xì)胞依賴的腫瘤血行轉(zhuǎn)移方面具有協(xié)同效應(yīng)。通過(guò)實(shí)驗(yàn)性肺轉(zhuǎn)移模型發(fā)現(xiàn),人參和丹參聯(lián)合使用能夠有效減少肺部腫瘤轉(zhuǎn)移。RNA測(cè)序顯示,這一效果可能與抑制腫瘤組織中中性粒細(xì)胞的募集有關(guān)。細(xì)胞粘附分子在調(diào)節(jié)中性粒細(xì)胞從血管向遠(yuǎn)端組織的遷移中起重要作用。分析顯示,人參和丹參下調(diào)了關(guān)鍵細(xì)胞粘附分子E-選擇素(E-selectin, CD62E)的表達(dá),尤其是在丹參的作用下,CD62E的表達(dá)顯著減少。進(jìn)一步從丹參中篩選出隱丹參酮能夠抑制TNF-α誘導(dǎo)的CD62E表達(dá),降低中性粒細(xì)胞與內(nèi)皮細(xì)胞的粘附,減少中性粒細(xì)胞募集到腫瘤部位。鑒于腫瘤細(xì)胞在腫瘤轉(zhuǎn)移中的重要作用,研究團(tuán)隊(duì)進(jìn)一步分離肺組織中性粒細(xì)胞進(jìn)行RNA測(cè)序,發(fā)現(xiàn)人參和丹參減少轉(zhuǎn)移灶NETs的形成。并且篩選出人參皂苷Rg1能夠抑制PMA誘導(dǎo)的NETs形成,從而降低了NETs對(duì)腫瘤細(xì)胞的侵襲、粘附和上皮間質(zhì)轉(zhuǎn)化的作用,維持了血管完整性。此外,人參皂苷Rg1與隱丹參酮聯(lián)合使用展現(xiàn)了顯著的抗腫瘤轉(zhuǎn)移效果,且具有一定的安全性。有望為原創(chuàng)性抑制腫瘤轉(zhuǎn)移復(fù)發(fā)的創(chuàng)新中藥提供重要的支持,造福癌癥患者,
博士研究生陸可沁、青年教師夏雅雯為論文共同第一作者。南京中醫(yī)藥大學(xué)陸茵教授、韋忠紅副教授和揚(yáng)州大學(xué)陶麗副教授為共同通訊作者。南京中醫(yī)藥大學(xué)為第一通訊單位。該研究獲得國(guó)家自然科學(xué)基金(81961128020,82374322,82474375,82405059),江蘇省高校自然科學(xué)基金(24KJB320011),南京中醫(yī)藥大學(xué)中藥一級(jí)學(xué)科開(kāi)放項(xiàng)目(2020YLXK20),天然藥物國(guó)家重點(diǎn)實(shí)驗(yàn)室開(kāi)放項(xiàng)目(No. SKLNMKF202301),江蘇省青年自然科學(xué)基金(No. BK20170516)和江蘇省研究生科研創(chuàng)新計(jì)劃項(xiàng)目(KYCX22-2038)的資助。
原文鏈接:
https://www.sciencedirect.com/science/article/pii/S2090123224004909?via%3Dihub







 版權(quán)所有? 2024南京中醫(yī)藥大學(xué) 網(wǎng)站備案號(hào):蘇ICP備15021406號(hào)-1 公安備案號(hào):蘇公網(wǎng)安備32010602010028號(hào)
版權(quán)所有? 2024南京中醫(yī)藥大學(xué) 網(wǎng)站備案號(hào):蘇ICP備15021406號(hào)-1 公安備案號(hào):蘇公網(wǎng)安備32010602010028號(hào)