2023年5月23日,南京中醫(yī)藥大學醫(yī)學院﹒整合醫(yī)學學院,附屬鼓樓臨床醫(yī)學院林煒教授課題組和浙江大學馮鈺教授團隊、中國科學院分子植物卓越創(chuàng)新中心趙國屏院士團隊以及中國科學院物理所王爽研究員團隊在國際著名期刊美國科學院院刊Proceedings of the National Academy of Sciences of the United States of America(中科院一區(qū),IF:12.779)上發(fā)表了題為“Structural insights into the transcription activation mechanism of the global regulator GlnR from actinobacteria”的研究成果。該研究捕獲了結核分枝桿菌GlnR依賴型基因轉錄激活復合物結構,揭示了全局性轉錄調控蛋白GlnR選擇性調控基因轉錄的分子機制,為全面認識結核分枝桿菌和整個放線菌的代謝調控機制奠定了基礎。該工作是林煒教授團隊繼Mol. Cell(2017, 2018)、Nat Commun(2019)、Nucleic Acids Res(2020, 2021, 2022a, 2022b)之后在病原菌基因轉錄調控機制研究和新型抗耐藥菌藥物靶點發(fā)現領域取得的又一項全新研究成果。

基因組遺傳信息得以表達,首先需要RNA聚合酶(RNAP)以DNA為模板合成RNA。對RNAP運行機理和調控機制的研究能夠回答基因表達調控的關鍵基礎科學問題。在轉錄起始階段,細菌的RNAP與轉錄起始s 因子形成復合物,依次執(zhí)行啟動子雙鏈DNA識別、解鏈等關鍵步驟,多種轉錄調控因子通過結合轉錄起始復合物,選擇性調控相關基因的轉錄。
結核分枝桿菌是兼性胞內寄生菌,其在宿主體內的存活能力是造成持續(xù)性感染的主要原因之一。針對宿主內的多種不利因素,結核菌會通過自身代謝重塑來適應和抵抗宿主體內的惡劣環(huán)境。氮代謝是生命活動過程中最基本的代謝活動。在各種生命體系中,氮代謝途徑都受到了嚴格而靈活的調控。對大腸桿菌的氮代謝調控網絡已研究的很全面,其轉錄調控主要由一對經典的雙組份系統(tǒng)NtrB/NtrC負責;而結核分枝桿菌不同,其氮代謝是由孤兒應答調控蛋白GlnR負責,GlnR在氮源匱乏條件下全局性調控結核菌的氮代謝基因轉錄。全局性轉錄調控因子GlnR不僅能在氮源匱乏的情況下會選擇性激活大多數氮同化基因的表達,還能協(xié)同調控菌體的碳、磷、次級代謝基因表達,全面理解結核菌在宿主體內等特殊生境下GlnR依賴型基因轉錄的選擇性調控機制能為破解結核菌潛伏感染提供新的思路。
文章解析了結核分枝桿菌OmpR/PhoB亞家族轉錄調控蛋白GlnR,啟動子DNA,及RNAP的復合物電鏡結構。該結構揭示了GlnR蛋白如何與啟動子DNA以及RNAP協(xié)同激活下游靶標基因轉錄。結構顯示4分子GlnR的C端DNA結合結構域分別依次頭尾相連排列結合在啟動子DNA上,而4分子GlnR的N端調控結構域首先分別各自形成二聚體,之后二聚體與二聚體之間進一步形成同源四聚體,由4分子GlnR的N端調控結構域形成的同源四聚體在GlnR的C端DNA結合結構域與RNAP之間扮演著“分子橋梁”的作用,拉近了啟動子DNA與RNA聚合酶核心酶之間的距離,穩(wěn)定了GlnR依賴型轉錄激活復合物,促進了GlnR調控的下游靶標基因的轉錄。GlnR采取的這種由4分子轉錄調控蛋白協(xié)同激活轉錄的機制與之前鑒定的由2分子轉錄調控蛋白激活的Class I、Class II、Class III的轉錄激活機制完全不同(圖1)。因此,該研究為全面理解細菌雙組份系統(tǒng)(Two component system,TCS)雙組份系統(tǒng)OmpR/PhoB亞家族應答調控蛋白調控轉錄的規(guī)律提供了基礎,也為抗耐藥結核分枝桿菌感染藥物的研發(fā)提供了新的思路和靶標。
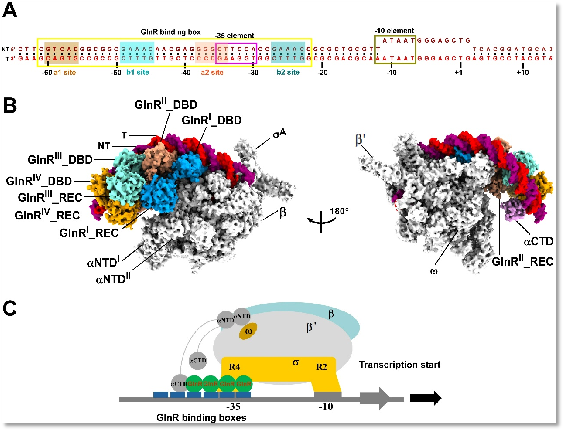
圖1. 結核分枝桿菌GlnR依賴型轉錄激活復合物的冷凍電鏡結構。
A. GlnR激活的下游靶標基因啟動子DNA scaffold;
B. GlnR依賴型轉錄激活復合物結構;
C. GlnR激活下游靶標基因轉錄的模型。
南京中醫(yī)藥大學為該論文的第一作者和通訊作者單位,林煒教授為該論文的第一通訊作者;史婧副教授為該論文的第一作者和共同通訊作者;碩士研究生馮貞貞為該論文的共同第一作者;本研究獲得了國家自然科學基金面上項目(82072240、32270192、32270037)、青年項目(81903526、32000025);江蘇省自然科學基金項目(BK20190798、BK20211302);江蘇省中藥資源產業(yè)化過程協(xié)同創(chuàng)新中心重點項目(ZDXM-2020-10);南京中醫(yī)藥大學中藥學一流學科開放課題項目(2020YLXK008、2020YLXK016)、江蘇省基礎醫(yī)學重點學科及教育部霍英東青年教師基金等項目資助。
原文鏈接:https://www.pnas.org/doi/10.1073/pnas.2300282120







 版權所有? 2024南京中醫(yī)藥大學 網站備案號:蘇ICP備15021406號-1 公安備案號:蘇公網安備32010602010028號
版權所有? 2024南京中醫(yī)藥大學 網站備案號:蘇ICP備15021406號-1 公安備案號:蘇公網安備32010602010028號