我校江蘇省中藥高效給藥系統(tǒng)工程技術(shù)研究中心近年來(lái)致力于智能型仿生多功能納米藥物遞送系統(tǒng)的構(gòu)建,著力解決活性成分生物利用度低、病灶部位靶向性差等問(wèn)題,為中藥活性組分的高效遞送以及復(fù)雜疾病的精準(zhǔn)治療提供思路。團(tuán)隊(duì)王若寧副教授研究小組在狄留慶教授指導(dǎo)下在國(guó)際知名學(xué)術(shù)期刊ACS Nano(IF:18.027,中科院分區(qū)1區(qū))在線發(fā)表最新研究成果。
由于血腦屏障(blood brain barrier, BBB)和血腦腫瘤屏障(blood brain tumor barrier, BBTB)的存在,大部分候選藥物無(wú)法有效地蓄積在腦膠質(zhì)瘤病灶部位。此外,免疫抑制微環(huán)境也是腦膠質(zhì)瘤治療的一大阻礙。因此,多策略聯(lián)合克服膠質(zhì)瘤的治療阻礙至關(guān)重要。基于前期工作基礎(chǔ)(Acta Pharmaceutica Sinica B. 2022, Journal of Controlled Release. 2022. 2023, Journal of Medicinal Chemistry. 2022, Journal of Nanobiotechnology. 2020),發(fā)現(xiàn)血清來(lái)源的外泌體(Exosome,EXO)表達(dá)有豐富的TfR,其可以通過(guò)與血液中游離的轉(zhuǎn)鐵蛋白結(jié)合,進(jìn)而靶向大腦。由于EXO是內(nèi)源性物質(zhì),所以相比于其它常用的納米載體具有更低的免疫原性,并且能夠逃避單核巨噬系統(tǒng)的吞噬,從而實(shí)現(xiàn)在體內(nèi)的長(zhǎng)循環(huán)。傳統(tǒng)中藥丹參中的脂溶性活性成分與甘草中的兩親性活性成分可通過(guò)自組裝策略構(gòu)建納米膠束(TanⅡA-GL nano-micelles, TGM),同時(shí)發(fā)揮不同組分間的協(xié)同治療作用。受EXO獨(dú)特理化性質(zhì)啟發(fā),團(tuán)隊(duì)將在EXO表面修飾了免疫佐劑CpG ODN 1826,成功構(gòu)建了腦膠質(zhì)瘤靶向及化療、免疫治療一體化的仿生納米遞送系統(tǒng),用于遞送納米膠束(TGM),以“Immune Exosomes Loading Self-assembled Nano-micelles Traverse the Blood-brain Barrier for Chemo-immunotherapy Against Glioblastoma”為題發(fā)表于ACS Nano上。該研究制備所得荷載中藥自組裝膠束的“免疫外泌體”納米粒,可以有效改善單一載體藥物荷載量低、生物相容性差、靶向穿透力弱、治療機(jī)制單一等問(wèn)題,能夠精準(zhǔn)靶向腦膠質(zhì)瘤病灶部位,通過(guò)化學(xué)療法和免疫療法協(xié)同治療腦膠質(zhì)瘤,在未來(lái)具有廣闊的應(yīng)用前景(Fig. 1)。
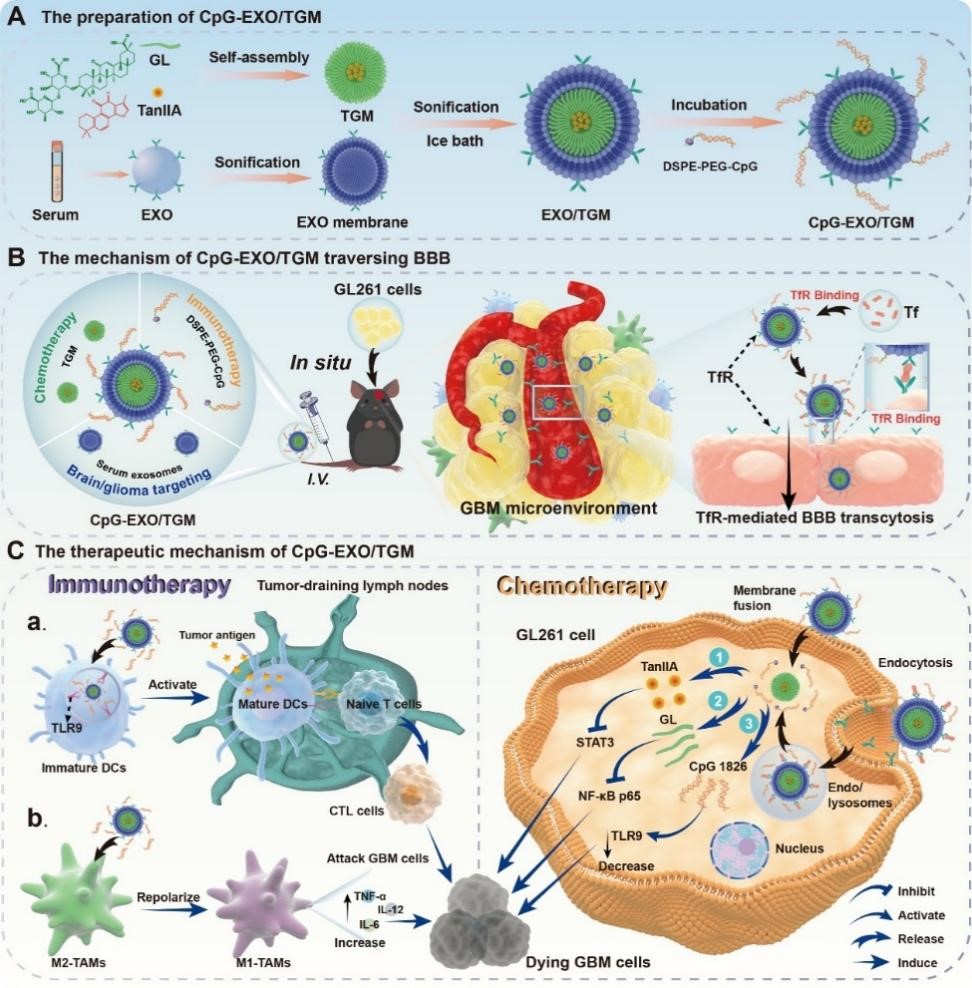
Fig. 1. The immune exosome nanoparticles of traditional Chinese medicine self-assembled micelles,
CpG-EXO/TGM, treated brain glioma together through chemotherapy and immunotherapy.
上述研究獲得國(guó)家自然科學(xué)基金(81903557、82274104、82074024)、江蘇省自然科學(xué)基金(BK20190802)、江蘇省高等學(xué)校自然科學(xué)基金(19KJB350003)、江蘇省科協(xié)青年科技人才托舉工程、中華中醫(yī)藥學(xué)會(huì)青年人才托舉工程A類項(xiàng)目(No. 2021-QNRC2-A01)、南京中醫(yī)藥大學(xué)自然科學(xué)基金青年項(xiàng)目(NZY81903557)、南京中醫(yī)藥大學(xué)中藥學(xué)一流學(xué)科開(kāi)放課題(2020YLXK019)等項(xiàng)目的資助支持。
原文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.2c10219







 版權(quán)所有? 2024南京中醫(yī)藥大學(xué) 網(wǎng)站備案號(hào):蘇ICP備15021406號(hào)-1 公安備案號(hào):蘇公網(wǎng)安備32010602010028號(hào)
版權(quán)所有? 2024南京中醫(yī)藥大學(xué) 網(wǎng)站備案號(hào):蘇ICP備15021406號(hào)-1 公安備案號(hào):蘇公網(wǎng)安備32010602010028號(hào)